Кетогенная диета при эндокринных расстройствах: современные перспективы
Кетогенная диета (КД) — это диета с высоким содержанием жиров, адекватным содержанием белка и низким содержанием углеводов, которая приводит к пищевому кетозу, давно известному своими противоэпилептическим эффектом и использовалась в терапевтических целях для лечения рефрактерной эпилепсии. В этом обзоре делается попытка обобщить данные и клиническое применение КД при диабете, ожирении и других эндокринных расстройствах. КД обычно проводится на основе животного белка. Был предложен эмпирический вегетарианский индийский вариант КД с учетом индийских пищевых привычек. КД оказывает благотворное влияние на ишемическое предварительное кондиционирование сердца, улучшает оксигенацию у пациентов с дыхательной недостаточностью, улучшает гликемический контроль у диабетиков, связана со значительной потерей веса и оказывает благотворное влияние на поликистоз яичников. Мультивитаминные добавки рекомендуются при КД. Недавно кетоны были предложены в качестве супер-метаболического питания; и КД в настоящее время считается подходящей диетотерапией для лечения диабета.
Введение
Кетогенная диета (КД) описывается как диета с высоким содержанием жиров, адекватным содержанием белков и низким содержанием углеводов. При недостаточном количестве углеводов организм сжигает жиры, а не углеводы, чтобы обеспечить себя энергией. Печень превращает жир в жирные кислоты и производит кетоновые тела (КТ), которые заменяют глюкозу в качестве основного источника энергии. Это диетическое накопление кетонов в крови также известно как пищевой кетоз (ПК).
Со времени введения КД в 1920 году проводились исследования, чтобы понять его механизмы и использование в различных клинических условиях. Из-за плейотропного воздействия на центральную нервную систему, клеточный метаболизм и метаболические пути, КД была изучен и показала многообещающие результаты при разнообразных неврологических расстройствах, черепно-мозговых травмах, угрях, раке и метаболических расстройствах. Недавно кетоны были предложены в качестве супер-метаболического питания из-за их различных благоприятных воздействий на клеточный метаболизм во многих тканях.
Таблица 1
Клиническое использование кетогенной диеты при различных расстройствах
| Эндокринные расстройства Сахарный диабет Тучность Метаболический синдром Поликистоз яичников Врожденный гиперинсулинизм Неалкогольная жировая болезнь печени Неврологические расстройства Эпилепсия Синдром Леннокса-Гасто Миоклонически-астатическая эпилепсия болезнь Паркинсона Болезнь Альцгеймера Боковой амиотрофический склероз Мигрень Нарколепсии Депрессия Аутизм Метаболические расстройства Дефицит переносчика глюкозы типа 1 Дефицит комплекса пируватдегидрогеназы Дефицит фосфофруктокиназы Другие Травма и ишемия Рак / злокачественные опухоли |
Этот обзор является попыткой обобщить данные о КД при диабете, ожирении и других эндокринных расстройствах. Мы также сосредоточились на применении КД в клинической практике, его преимуществах, а также на предостережениях и противопоказаниях к его применению.
Физиология кетогенной диеты
Глюкоза и жирные кислоты метаболизируются до ацетилкофермента A (CoA) (продукта неполного расщепления свободных жирных кислот [FFAs] в печени), чтобы войти в цикл лимонной кислоты (цикл трикарбоновых кислот) путем конденсации с оксалоацетатом (предшественник пирувата) , Поскольку на КД гликолиз падает до очень низкого уровня из-за низкого содержания углеводов, оксалоацетат не может конденсироваться с ацетил-КоА, образующимся в результате метаболизма жирных кислот. Это приводит к шунтированию ацетил-КоА для кетогенеза и приводит к накоплению кетонов. КТ синтезируются в организме в β-гидроксибутират (βOHB), ацетоацетат и ацетон, которые также могут пересекать гематоэнцефалический барьер, чтобы обеспечить альтернативный источник энергии для мозга. Сердце, мышцы и почечная кора могут легко использовать КТ, в то время как мозг использует кетоны только при длительном голодании. Эритроциты не используют кетоны, поскольку у них нет митохондрий. Печень не использует кетоны, так как в ней нет фермента тиофоразы.
Накопление кетонов у конкретного человека зависит от нескольких физиологических параметров, таких как процентное содержание жира в организме, индекс массы тела (ИМТ) и скорость метаболизма в покое. КД в идеале следует вводить в контролируемой среде. КД является довольно безопасным методом, поскольку концентрация кетонов у людей на КД намного ниже, чем концентрация, наблюдаемая при диабетическом кетоацидозе, и не связана с какими-либо изменениями рН крови. Здесь следует упомянуть, что питание человека начинается с КД: молоко матери является кетогенным и полностью удовлетворяет потребности новорожденного.
Предполагается, что такая диета может способствовать большей потере жира с сохранением мышечной массы тела. Этот эффект частично обусловлен снижением уровня инсулина в плазме. Риск потери мышечной массы тела и саркопению можно предотвратить с помощью разумного добавления аминокислот и белка молочной сыворотки. Исследования показали индукцию фактора роста фибробластов (FGF-1). FGF-1 действует как метаболический регулятор липолиза, фосфата сыворотки, активного уровня витамина D и клиренса триглицеридов в печени.
Благотворное влияние кетогенной диеты
Кетоны, как «сверхтопливо» эффективно вырабатывает больше энергии аденозинтрифосфата (АТФ), чем глюкоза или жирные кислоты, за счет уменьшения митохондриальной пары никотинамид-аденин-динуклеотид и окисления пары кофермента Q. 100 г ацетоацетата способны генерировать 9,4 кг АТФ, а 100 г 3-гидроксибутирата дает 10,5 кг АТФ, в то время как 100 г глюкозы дает только 8,7 кг АТФ. Это позволяет организму поддерживать эффективную выработку энергии на фоне потери калорий. Кетоны также уменьшают повреждение свободных радикалов и увеличивает антиоксидантную способность путем активации фактора 2, связанного с NF E2, который усиливает транскрипцию генов, участвующих в защите от окислительного повреждения.
Влияние на центральную нервную систему
Существуют исследования, подтверждающие возможное терапевтическое использование КД при множественных неврологических расстройствах. Потенциальным механизмом может быть нейропротекторный эффект путем модуляции использования клеточной энергии. Было показано, что пищевой кетоз(ПК) улучшает физическую и когнитивную деятельность, улучшает церебральную функцию и продлевает выживание у аноксических крыс и мышей. ПК также улучшает посттравматический метаболизм у человека. КД считается неотъемлемой частью интегративного подхода, наряду с лекарственной терапией, в основных центрах эпилепсии во всем мире. Биоэнергетический переход от глюкозы к КТ может метаболически нацеливаться на опухоли головного мозга через интегрированные противовоспалительные пути / механизмы. Усиленная фагоцитарная активность макрофагов, антиангиогенных и проапоптотических механизмов снижает энергетический метаболизм опухоли и гликолитическую энергию, необходимую для роста опухоли.
Влияние на сердце
Сердечная мышца является «всеядной», использует разнообразные субстраты в качестве источников питания, предпочитая жирные кислоты, преимущественно среднецепочечные триглицериды, затем глюкозу, кетоны, лактат, пируват, гликоген и аминокислоты. Пищевой кетоз приводит к сдвигу метаболизма питания миокарда от окисления жира / глюкозы к более энергоэффективному кетоновому питанию и повышает эффективность и функцию работы миокарда. Больное сердце способствует метаболическому сдвигу питания в сторону кетонов для окислительного производства АТФ, вызванного снижением способности к окислению жирных кислот (основного питания для нормального сердца взрослого млекопитающего). Он ослабляет повреждение, вызванное свободными радикалами, улучшает энергетические резервы сердца, увеличивает содержание ацетил-КоА в миокарде и улучшает преобразование потребления кислорода в эффективность работы на уровне митохондрий в слабеющем миокарде и тем самым усиливает метаболизм миокарда. Исследования показали, что он предотвращает повреждение ишемической ткани на животных моделях, перенесших инфаркты миокарда или инсульт, что приводит к значительному уменьшению площади ишемического / некротического поражения. Электронно-микроскопические исследования показывают увеличение количества митохондрий, толерантность к ишемии и более быстрому восстановлению сердечной функции после реперфузии у крыс, получавших КД; следовательно, он является кардиозащитным.
Воздействие на дыхательную систему
КД уменьшает потребность в синтезе глюкозы в печени и способствует выделению ее прекурсоров, мышечные аминокислоты, уменьшает апоптоз в клетках. Способствует гибели клеток легких, вызванную геморрагическим шоком. Кроме того, КД полезна при респираторных заболеваниях. Помогает снизить коэффициент дыхательного обмена, выброс углекислого газа и парциальное давление углекислого газа, что является полезным для пациентов с повышенным парциальным давлением углекислого газа в артериальной крови из-за дыхательной недостаточности.
Применение кетогенной диеты
В этом разделе описывается отбор пациентов, консультирование и оценка перед КД, реализация КД, добавки, последующее наблюдение / мониторинг и возможное прекращение КД.
Отбор пациентов и оценка прекетогенной диеты
Оценка до КД требует детального анамнеза и физического обследования, специальных лабораторных тестов, оценки питания и консультирования пациента и членов семьи. У некоторых пациентов с определенными нарушениями обмена веществ могут быть абсолютные противопоказания к началу КД. Кроме того, осложняющие факторы риска (камни в почках, тяжелая дислипидемия, заболевания печени, тяжелый гастроэзофагеальный рефлюкс, плохое пероральное потребление, кардиомиопатия и хронический метаболический ацидоз) могут служить противопоказаниями к КД.
Многие терапевтические препараты, включая противосудорожные препараты, могут иметь высокое содержание углеводов и должны быть заменены на препараты с меньшим содержанием углеводов, если есть возможность. Пациентам следует начинать прием поливитаминов, содержащих адекватные дозы основных минералов, а также добавок кальция до начала КД.
Применение
Планирование КД требует инструкций по питанию, чтобы снизить потребление углеводов до <20 г / день, увеличить потребление жиров / масел и включить пищевые добавки для поддержания потребности человека в калориях. Общее количество калорий, которое должно потребляться конкретным человеком, основано на антропометрических измерениях, предшествующем рационе питания и физической активности. Различные варианты меню обсуждаются в Таблице 2. Диету следует изменить, если у пациента плохая переносимость и частые желудочно-кишечные симптомы.
Таблица 2:
Примерные варианты меню для кетогенной диеты
Вегетарианцы | Не вегетарианцы |
| Завтрак Сыр / панир пакора | Завтрак Яичница-болтунья / яйца вкрутую с моцареллой и кусочками салями |
| Второй завтрак Фриттата с грибами и луком | Второй завтрак Свинина или курица |
| Обед Шпинатные оладьи из льняной муки и большого количества сыра | Обед Мясной пирог |
| Полдник Овощные рулетики в салате с ореховым соусом | Полдник Пирожки с гамбургером и сливочно-томатным соусом |
| Ужин Блины из миндальной муки и семян чиа | Ужин Запеченный лосось с лимоном и маслом |
| Десерт Яблочно-цуккини торт | Десерт Шоколадный мусс или шоколадные трюфели |
*Как правило, диета должна обеспечивать 80-90% энергии от жира в соотношении граммов жира к грамму белка и углеводов в виде «4: 1», то есть 4 г жира на 1 г белка плюс углевод. , (Например, диета 1500 ккал может содержать 133,5 г жира с 55 г белка + 20 г углевода)
КД предполагает гибкость использования триглицеридов с длинной цепью (LCT) или триглицеридов со средней длиной цепи (MCT). Омега-3 добавки имеют свои положительные эффекты. Жирная диета предполагает низкое содержание углеводов, фруктов и овощей в каждом приеме пищи.
Ограничение жидкости не требуется, также можно продолжать вести обычный образ жизни, физические нагрузки. Не содержащие углеводов или содержащие минимальное количество углеводов поливитамины и мультиминеральные препараты следует вводить для предотвращения дефицита питательных веществ. Питательные вещества, в значительной степени необходимые для КД, это кальций с витамином D, селен, магний, цинк и фосфор. Оценка диеты должна проводиться периодически, чтобы контролировать положительные эффекты и связанные с ними риски.
Мониторинг кетонов в моче необходим для правильного управления рационом. Как правило, пациентам с КД следует контролировать уровень глюкозы в сыворотке, альбумина, общего белка, общего холестерина, триглицеридов и креатинина в сыворотке один раз в 3 месяца. Один раз в год ультразвуковое исследование почек, плотность костей, карнитин, уровни селена и электрокардиограмма играют важную роль в предотвращении таких долгосрочных эффектов, как нефролитиаз, остеопороз, гиперлипидемия, дефицит карнитина и кардиомиопатия.
Хотя КД оказалась безопасной и эффективным у пациентов с патологическим ожирением, которым назначена лапароскопическая бариатрическая хирургия, имеется мало данных о КД, используемых для предбариатрической хирургии при лечении патологического ожирения. Большинство исследований поддерживают использование диет с ограниченной энергией для предоперационной потери веса, что, как доказано, снижает риск послеоперационных осложнений, уменьшает объем печени и содержание жира у пациентов с ожирением для улучшения результатов лечения.
Посткетогенная оценка диеты
Диета может быть внезапно прервана в чрезвычайной ситуации, но чаще всего она постепенно уменьшается в течение 2–3 месяцев, постепенно снижая кетогенное соотношение с 4: 1–3: 1–2: 1. Калории и жидкости увеличиваются, и большее количество углеводной пищи и пищевых добавок вновь вводится с потерей мочевых кетонов.
Доказательства кетогенной диеты при эндокринных расстройствах
Благоприятное влияние КД на усвоение калорий, массу тела, параметры липидов, гликемические показатели и чувствительность к инсулину делает его терапевтическим вариантом при метаболическом синдроме, ожирении и диабете 2 типа с ожирением. Различные гормоны, такие как инсулин, глюкагон, кортизол, катехоламины и гормон роста, также значительно влияют на метаболизм кетоновых тел.
Сахарный диабет
Различные диетические модификации были изучены для улучшения контроля гликемии, такие как низкокалорийная диета, диета с низким содержанием жиров, диета с низким содержанием белка, диета с высоким содержанием белка и диета с низкой гликемической нагрузкой. Поскольку пищевые углеводы являются основным макроэлементом, повышающим уровень глюкозы в крови, исследователи стремились снизить количество углеводов в еде, чтобы изучить влияние на гликемическую нагрузку, режим антидиабета и дозировку лекарств среди людей с диабетом. Ограничение потребления углеводов с пищей достоверно снижает высокий уровень глюкозы в крови, не требует потери веса (хотя все же лучше всего подходит для снижения веса) и приводит к снижению или отмене лекарств. Исследования КД, изучающие пользу от изменения гликемических показателей и другие метаболические параметры у пациентов с диабетом 2 типа приведены в таблице 3.
Таблица 3
Исследования кетогенной диеты при сахарном диабете 2 типа
| Год и место исследования | Описание пациентов | Вмешательство и продолжительность | Параметры исследования | Результаты |
| Westman et al. 2008 США | 84 добровольца с ожирением и диабетом 2 типа 18-65 лет с ИМТ: 27-50 кг / м2 | Назначенные случайным образом пищевые добавки и упражнения для LCKD и LGID рекомендовано 24 недели 49 (58,3%) завершено исследование | HbA1c, глюкоза натощак, инсулин натощак, потеря веса, холестерин | HbA1c, уровень глюкозы натощак, уровень инсулина натощак, снижение веса в обеих группах Значительно большее улучшение среди группы LCKD в HbA1c (P = 0,03) Вес тела (P = 0,008) Холестерин ЛПВП (р <0,001) Снижение антидиабетических препаратов до 95,2% в группе с LCKD по сравнению с 62% в группе с LGID (P <0,01) |
| Дашти и соавт. 2007 | 64 здоровых пациента с ожирением и диабетом | Параметры исследования, определенные до и через 8, 16, 24, 48 и 58 недель после введения КД | Масса тела, ИМТ, уровень глюкозы в крови, общий холестерин, ЛПНП-холестерин, триглицериды и мочевина | Значительное снижение массы тела, ИМТ, уровня глюкозы в крови, общего холестерина, ЛПНП-холестерина, триглицеридов и мочевины с 1-56 недели (р <0,0001) ЛПВП-холестерин значительно увеличился (р <0,0001) Более значимые результаты у субъектов с гипергликемией |
| Боден и соавт. 2005 Университетская больница | 10 пациентов с ожирением с СД 2 типа | Стационарное сравнение 2 диет Обычные диеты в течение 7 дней с последующим КД в течение 14 дней | Потеря веса, 24-часовой профиль глюкозы в крови, чувствительность к инсулину Уровни HbA1c, триглицеридов и холестерина | КД привела к значительным результатам Спонтанное снижение потребления энергии Потеря веса Улучшение суточных показателей глюкозы в крови, чувствительности к инсулину и уровня HbA1c. Снижение уровня триглицеридов и холестерина в плазме. |
| Янси и др. 2005 Дарем VAMC клиника, США | 21 тип 2 диабетиков с избыточным весом 3 белых, 8 Средний афроамериканец ± SD возраст 56,0 ± 7,9 лет ИМТ 42,2 ± 5,8 кг / м2 | LCKD консультирование Корректировка лекарств 16 недель | HbA1c, триглицериды в сыворотке натощак, дозировка препарата и измерение талии | HbA1c снизился на 16% Средняя масса тела снизилась на 6,6% Уровень триглицеридов в сыворотке крови натощак снизился на 42% Снижение антигипергликемических препаратов Положительное влияние на измерение талии |
| Gumbiner et al. 1996 | 13 пациентов с ожирением и сахарным диабетом 2 типа | 7 пациентов, получавших высококетогенную VLED в течение 3 недель 6 пациентов, получавших низкокетогенную VLED в течение 3 недель Пациенты пересекались и получали альтернативную диету еще 3 недели | Содержание инсулина в плазме натощак и OGTT, концентрации С-пептида и ГГО | Голодание и OGTT-гликемия были ниже во время лечения высококетогенным VLED (P <0,05). Сильная корреляция между базальным HGO и кетоновыми телами плазмы натощак (P <0,05) Нет значительной разницы в потере веса, концентрации инсулина и C-пептида в плазме натощак и OGTT |
*VLED = диеты с очень низкой энергией, HGO = уровень глюкозы в печени, LCKD = кетогенная диета с низким содержанием углеводов, КД = кетогенная диета, LGID = диета с низкой гликемией и пониженной калорийностью, HDL = липопротеин высокой плотности, OGTT = оральный тест на толерантность к глюкозе, VAMC = Медицинский центр по делам ветеранов, ИМТ = индекс массы тела, SD = стандартное отклонение, СД = сахарный диабет, LDL = липопротеин низкой плотности, HbA1c = гликозилированный гемоглобин
Анализ карты КД с точки зрения диабета выявляет тесную связь между путем инсулинорезистентности и КД. Это подчеркивает, что элементы липидного обмена могут способствовать правильной клеточной локализации переносчиков глюкозы, рециркуляция и кетоты могут облегчать определенные воспалительные процессы, блокируя специфические цитокины. При увеличении кетонов в плазме наблюдается снижение уровня глюкозы в плазме, снижение метаболизма мозга, уровень глюкозы (CMRglc) и повышенная скорость метаболизма ацетоацетата (CMRa) в головном мозге. У пациентов с ожирением с СД 2 типа, высококетогенное лечение VLED снижает голодание, гликемию OGTT и улучшает гликемический контроль. КД с высоким содержанием белка и низким содержанием углеводов уменьшает чувство голода и снижает потребление пищи. RL значительно полезны в улучшении гликемического контроля (гликированный гемоглобин), устранении / уменьшении диабетических лекарств, увеличении липопротеина-холестерина высокой плотности (HDL-C) и вызывают потерю веса у людей с избыточным весом и ожирением с диабетом типа 2 в течение 24 недель период по сравнению с диетой с низким гликемическим индексом. Кроме того, ограничение как белка, так и углеводов в КД обращает вспять диабетическую нефропатию. Однако такая диета может не помочь предотвратить снижение функции β-клеток и не может улучшить секреторную функцию инсулина или массу β-клеток.
Было показано, что ингибиторы котранспортера 2 глюкозы натрия (SGLT2), особенно эмпаглифлозин и канаглифлозин, имеют сердечно-сосудистые преимущества у пациентов с диабетом 2 типа. Ингибиторы SGLT 2 также проявляют про-кетогенные эффекты, опосредуя метаболический переход от утилизации глюкозы к липидам. Как класс они увеличивают производство кетонов в печени, повышая уровни глюкагона и уменьшая соотношение инсулин: глюкагон. Один из предполагаемых механизмов их исключительной сердечно-сосудистой и почечной пользы у пациентов с диабетом 2 типа, вероятно, обусловлен легким кетозом с этими препаратами, что приводит к улучшению периферической чувствительности к инсулину, снижению гиперинсулинемического стресса и присущей ему секреции инсулина с пониженной потребностью в наружном инсулине. Легкий кетоз также оказывает благотворное влияние на метаболизм миокарда, для сердца, страдающего диабетом. Тем не менее, пациенты с диабетом 2 типа, которые уже получают ингибиторы SGLT2, имеют значительно более высокий риск развития диабетического кетоацидоза при диабете с низким содержанием углеводов; следовательно, КД не следует назначать пациентам с диабетом 2 типа на ингибиторах SGLT2.
У пациентов с сахарным диабетом ограничение углеводов может повышать риск развития гипогликемии, особенно у пациентов, получающих инсулин и стимуляторы секреции инсулина (сульфонилмочевины, препараты на основе инкретина). Следовательно, перед началом такой диеты рекомендуется изменить дозировку лекарственного средства в зависимости от гликемического контроля и класса лекарственной терапии против диабета.
Ожирение
У пациентов с ожирением лечение КД показало большую потерю веса по сравнению с другими сбалансированными диетами. Эта сравнительно большая потеря веса делает его альтернативным средством против ожирения. Возможными механизмами более высокой потери веса могут быть борьба с голодом из-за более высокого потребления белков, прямого действия подавления аппетита кетонами и изменений в кровообращении. уровень некоторых гормонов, таких как грелин и лептин, которые контролирует аппетит. Другими предлагаемыми механизмами являются снижение липогенеза, усиление липолиза, снижение дыхательного коэффициента, увеличение метаболических затрат на глюконеогенез и термический эффект белков.
Исследование, проведенное Castaldo et al. в 2016 году показано, что кратковременная КД, сопровождаемый пероральным питанием, почти не содержащим углеводов, может эффективно снизить массу тела, окружность талии, кровяное давление и резистентность к инсулину у клинически здоровых взрослых с патологическим ожирением (ИМТ ≥45 кг / м2). Диета значительно снижает уровень холестерина, глюкозы в крови, массы тела, ИМТ и тем самым снижает факторы риска развития различных хронических заболеваний у пациентов с ожирением и гиперхолестеринемией (ИМТ> 35 кг / м2) без каких-либо побочных эффектов в долгосрочной перспективе.
Метаболический синдром
Резистентность к инсулину в периферических тканях проявляется в виде гипергликемии, гиперинсулинемии, аномального метаболизма жирных кислот и атерогенной дислипидемии при МетС, а также сердечно-сосудистых заболеваний. Углеводы с пищей модулируют липолиз, сборку и процессинг липопротеинов. КД в долгосрочной перспективе (12 месяцев или более) приводит к снижению массы тела, триглицеридов и диастолического артериального давления, тогда как вызывает повышение уровня ЛПВП-Х и низкой плотности. липопротеин-С по сравнению с диетой с низким содержанием жира.
Повышенный уровень βOHB в плазме коррелирует со снижением уровня холестерина в плазме, мевалоната (биомаркера синтеза холестерина в печени) и снижением уровня предшественников мевалоната ацетоацетил-КоА и 3-гидрокси-3-метилглутарил-КоА в печени. Увеличение βOHB способствует неатерогенному липидному профилю, улучшает параметры сердечно-сосудистого риска, снижает артериальное давление, снижает резистентность к инсулину без какого-либо неблагоприятного влияния на функции почек или печени.
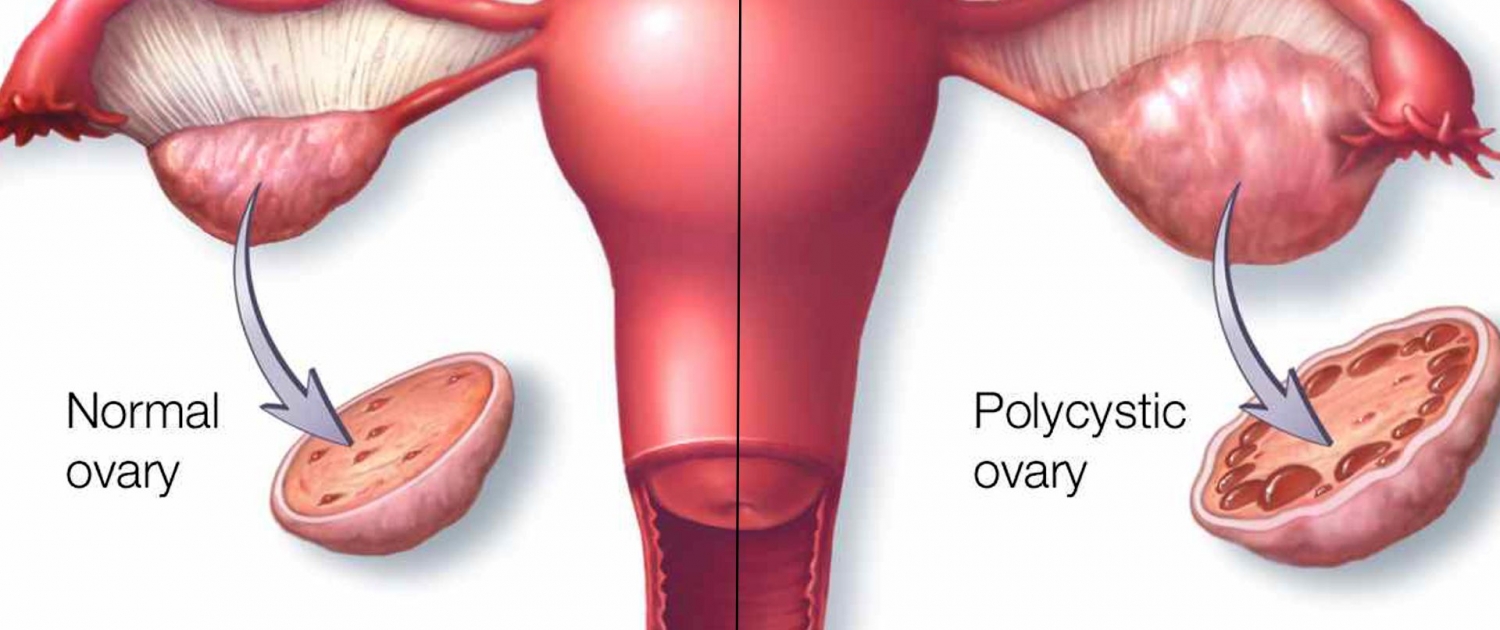
Синдром поликистоза яичников
Синдром поликистозных яичников (СПКЯ) связан с ожирением, гиперинсулинемией, инсулинорезистентностью, репродуктивными и метаболическими последствиями. Метаболические и эндокринные эффекты низко-углеводного питания (КД) способствуют нормалицации массы тела, процентного содержания свободного тестостерона, соотношением лютеинизирующего гормона / фолликулостимулирующего гормона и уровня инсулина натощак. Это приводит к снижению секреции андрогенов и увеличению глобулина, связывающего половые гормоны, улучшает чувствительность к инсулину и тем самым перенормирует эндокринные функции. Такое диетическое вмешательство и управление образом жизни оказывает благоприятное воздействие при лечении пациентов с СПКЯ, страдающих ожирением и диабетом типа 2. Также было показано, что оно улучшает симптомы депрессии, психологические расстройства и качество жизни, связанное со здоровьем у этих пациентов.
Подробное обсуждение КД при неэндокринных расстройствах выходит за рамки этого обзора. Возможные специфические для заболевания модифицирующие эффекты КД при неэндокринных расстройствах приведены в таблице 4.
Таблица 4
Специфические модифицирующие заболевания эффекты кетогенной диеты при неэндокринных расстройствах
| Заболевание | Благоприятные эффекты |
| Метаболизм | Благоприятные эффекты при синдроме дефицита GLUT1 и дефиците PDHC Улучшение толерантности к физической нагрузке и снижение базовых уровней креатининкиназы при болезни Макардла Обеспечивает энергетические субстраты в гликолизе для превращения фруктозо-6-фосфата во фруктозу-1, 6-бисфосфат при дефиците ПФК Улучшение мышечной силы и основных этапов развития у пациентов с мутациями в изоформе мышц ПФК, миопатии и артрогрипоза |
| Нейродегенеративные расстройства | Может регулировать семейство белков (сиртуинов), которые играют главную роль в обеспечении «омолаживающего» эффекта ограничения калорий |
| болезнь Паркинсона | Может регулировать основной чувствительный к энергии белок в клетке, 5′-AMP-активированную киназу, имеющую нижестоящие эффекторы, которые могут обладать нейропротекторными свойствами |
| болезнь Альцгеймера | Благотворное влияние на потребление глюкозы и нейротрофический фактор мозга Может защищать от отложения амилоида и позволяет клеткам преодолевать амилоид-индуцированную дисфункцию ПДГ |
| Боковой амиотрофический склероз | Может обеспечить субстрат для обхода нарушенного или плохо функционирующего комплекса I |
| Мигрень, головная боль, нарколепсия | Ограниченные исследования Механизм пользы неясен |
| Депрессия | Подобные поведенческие изменения как при приеме антидепрессантов |
| Травма | Кетоны могут быть предпочтительным питаниеи в поврежденном мозге, следовательно, защищают от травм и ишемии. Значительное уменьшение области контузии коры наблюдалось у крыс. |
| Ишемия | Увеличение количества митохондрий в сердечной мышце приводит к улучшению способности генерировать энергию с кардиозащитным эффектом при ишемическом инсульте |
| Рак / опухоли | Опухолевые клетки Брайана менее способны, чем здоровая ткань мозга, использовать кетоны в качестве источника энергии. Может ограничивать глюкозу, необходимую для производства компонентов, важных для роста пролиферативных клеток в опухолевых клетках Обеспечить дополнительный энергетический субстрат для нормальных здоровых тканей |
КД = кетогенная диета, GLUT-1 = транспортер глюкозы 1-го типа, ЦНС = центральная нервная система, PDH = пируватдегидрогеназа, TCA = трикарбоновая кислота, PFK = фосфофруктокиназа, AMP = аденозинмонофосфат, PDHC = пируватдегидрогенатрияминазы, GABA = гамма-гамма кислота
Побочные эффекты
Побочные эффекты могут быть классифицированы как легкие, средние и тяжелые или краткосрочные и долгосрочные [Таблица 5]. Распространенные побочные эффекты являются слабыми и включают головную боль, запор, диарею, бессонницу и боль в спине. Высокий уровень MCTs в КД может вызвать желудочно-кишечный дискомфорт со спазмами в животе, диарей и рвотой. Умеренные побочные эффекты включали дислипидемию, дефицит минералов, метаболический ацидоз и повышенный риск почечных камней. Это может привести к повышению уровня триглицеридов в течение 6 месяцев. Также часто наблюдается гипопротеинемия; что может быть связано с уменьшением потребления белка. Тяжелые последствия связаны с повышенным уровнем кетонов, которые могут привести к осложнениям из-за повышения окислительно-восстановительного дисбаланса и, следовательно, к риску заболеваемости и смертности у пациентов с диабетом. Что касается возможного ацидоза во время КД, так как концентрация кетонов никогда не поднимается выше 8 ммоль / л, этот риск практически отсутствует у субъектов с нормальной функцией инсулина.
Таблица 5
Неблагоприятные эффекты кетогенных диет
| Краткосрочные эффекты Тошнота / рвота Запор дегидратация анорексия вялость гипогликемия Ацидоз Долгосрочные эффекты Нарушения липидного обмена Тяжелый стеатоз печени Гипопротеинемия Минеральные недостатки Увеличение окислительно-восстановительного дисбаланса кардиомиопатия Нефролитиаз |
Длительная КД вызывает непереносимость глюкозы, связанную с недостаточной секрецией инсулина, резистентностью к инсулину и снижением массы бета- и альфа-клеток у мышей (длительное воздействие на эндокринные клетки поджелудочной железы). Существует риск увеличения количества висцерального жира и жира в костном мозге, повышения уровня лептина, снижения инсулиноподобного фактора роста 1, снижения минеральной плотности костей, снижения транскрипционных факторов, способствующих остеобластогенезу, и, следовательно, снижению образования костей. Плазменные маркеры, связанные с дислипидемией и воспалением (холестерин, триглицериды, лептин, хемотаксический белок-1 моноцитов, интерлейкин [IL] -1 и IL-6), были увеличены, и у мышей, которых кормили КД, появились признаки стеатоза печени после 22 недель КД.
Некоторые из побочных эффектов могут быть предотвращены и легко излечимы, такие как обезвоживание, гипогликемия и легкий ацидоз. Меньшее количество МСТ в сочетании с ЛКТ и увеличение частоты приема пищи могут улучшить толерантность к диете. Пищевые добавки с кальцием, селеном, цинком, витамином D и пероральными щелочами назначаются для уменьшения случаев дефицита питательных веществ и почечных камней. Н2-блокаторы или ингибиторы протонной помпы могут быть назначены для предотвращения нарушения моторики желудочно-кишечного тракта и гастроэзофагеального рефлюкса. Кроме того, для преодоления запоров рекомендуются овощи с высоким содержанием клетчатки, достаточное количество жидкости и, при необходимости, слабительные без углеводов.
Предостережения и противопоказания
Метаболическая адаптация к КД включает переход от использования углеводов к липидам в качестве основного источника энергии. Таким образом, у пациента с нарушением жирового обмена может развиться разрушительный катаболический кризис (т. Е. Кома, смерть) в условиях поста или КД. Таким образом, перед началом КД пациенты должны пройти обследование на предмет нарушений транспорта и окисления жирных кислот, особенно у детей с нарушениями судорог и нарушениями развития. КД также противопоказана при порфирии (нарушение биосинтеза гема, при котором наблюдается дефицит порфобилиноген-деаминазы), а также пациентам с дефицитом фермента пируваткарбоксилазы [Таблица 6]. Следовательно, подробный анамнез, физикальное обследование, Оценка роста у детей и рутинный лабораторный мониторинг необходимы до начала КД и во время следования. КД не следует рекомендовать пациентам с диабетом, принимающим ингибиторы SGLT2, как обсуждалось в предыдущем разделе.
Таблица 6
Предостережения и противопоказания кетогенной диеты
| Врожденные нарушения жирового обмена и дефицит ферментов MCAD LCAD SCAD Длинноцепочечный дефицит 3-гидроксиацил-КоА Среднецепочечный дефицит 3-гидроксиацил-КоА Бета-окислительные дефекты в митохондриях Дефицит пируваткарбоксилазы Дефицит карнитина CPT I или II дефицит Карнитинтранслоказный дефицит порфирия Другие осложняющие факторы риска Почечные камни Тяжелая дислипидемия Значительное заболевание печени Неспособность процветать Выраженный гастроэзофагеальный рефлюкс Плохой оральный прием кардиомиопатия Хронический метаболический ацидоз Пациенты, получающие ингибиторы SGLT 2 |
*SGLT 2 = натрий-глюкозный ко-транспортер 2, CPT = карнитинпальмитоилтрансфераза, SCAD = дефицит короткоцепочечной ацилдегидрогеназы, LCAD = дефицит длинноцепочечной ацилдегидрогеназы, MCAD = дефицит ацилдегидрогеназы со средней длиной цепи
Заключение
Существуют клинические данные, подтверждающие использование КД при диабете, ожирении и эндокринных расстройствах. КД вызывает интерес, но должна быть проведен под строгим медицинским наблюдением диетологов и врачей, чтобы быть эффективной и, следовательно, может потребоваться пребывание в больнице во время ее начала. Чтобы облегчить пациенту приемлемость, переносимость и вкусовые качества, протоколы диеты постепенно изменяются, включая введение диеты с постом или без него, регулярные наблюдения для минимизации осложнений, изменения соотношения компонентов жира и состава жирных кислот. Такие диеты могут положительно влиять на гормональный баланс и эндокринологические расстройства, но необходимы будущие исследования для оценки долгосрочных последствий для здоровья и устранения диабетических осложнений у людей. Понимание клинического воздействия, безопасности, переносимости, эффективности, продолжительности лечения и прогноза после прекращения диеты является сложной задачей и требует дальнейших исследований для понимания механизмов, специфичных для заболевания.
P.S. Если хотите пройти с нами марафон с кето и не только, который начнется 1 ноября 2019 года, то подробности и регистрация здесь: https://riin.ru/enrol/index.php?id=54
Ссылки на исследования использованные в статье:
Источники
Статья из журнала J Postgrad Med 2017 окт-дек; 63(4): 242–251.
Авторы: L Gupta, D Khandelwal, S Kalra, P Gupta, D Dutta, and S Aggarwal
Перевод: Доктор Бонд.